Лабораторна робота № 1. „Визначення теплоти розчинення і гідратації солі”
Мета роботи:
1. Познайомитись з калориметричним методом вимірювання теплових ефектів.
2. Визначити теплоти розчинення безводного купрум (II) сульфату і мідного купоросу.
3. Визначити теплоту утворення кристалогідрату СuSО4•5Н2О з безводної солі.
На занятті необхідно:
1. Виконати роботу у відповідності до вимог даної методичної розробки.
2. Навчитись користуватись калориметром та визначати його теплоємність.
3. Розрахувати теплоту розчинення солі та теплоту гідратації.
4. Оформити звіт про виконану роботу і здати його викладачу.
Перелік обладнання та реактивів:
1. Калориметр;
2. термометр;
3. технохімічні ваги;
4. пробірки (3 шт.);
5. секундомір;
6. порцелянова ступка;
7. KNO3
8. СuSО4, СuSО4•5Н2О
Порядок виконання роботи:
Дослід 1. Визначення сталої калориметра
1. Суху пробірку попередньо зважити на технохімічних терезах.
2. Ретельно розтерти калій нітрат в порцеляновій ступці і засипати його у зважену пробірку приблизно на ¼ її висоти.
3. Зважити на технохімічних терезах пробірку з сіллю (з точністю до 0,01г). За різницею зважувань знайти масу солі, що повинна знаходитись в межах 4 -7 г. Отримані дані занести в таблицю 1.
4. У стакан калориметра налити 250 мл води, закрити калориметр кришкою і встановити в менший її отвір термометр, а в більший– пробірку з сіллю. (Для того щоб пробірка не провалювалась в калориметр на неї потрібно надіти гумове кільце!).
5. Вимірювання провести в три етапи (періоди): попередній, головний і заключний.
6. Ввімкнути калориметр в мережу змінного струму, потім ввімкнути тумблером мішалку, а через 1-2 хвилини– секундомір.
7. Попередній етап: вимірювання температури провести з точністю до 0,5°С через кожні 30 сек. протягом 5 хв.
8. Головний етап: не виключаючи секундоміра роз бити пробірку з сіллю так, щоб вся сіль висипалась у воду. Якщо температура змінюється дуже швидко, реєструвати її з меншою точністю.
9. Заключний етап: іще провести вимірювання температури через кожні 30 сек. протягом 5 хв. до встановлення рівномірного ходу температури (теж з точністю до 0,5°С).
10.Дані всіх вимірювань занести в таблицю 2.
11.Для розрахунку точної зміни температури на міліметровому папері побудувати графік, відкладаючи по вісі абсцис час, а по вісі ординат– зміну температури (масштаб на абсцисі- 1хв: 1см, а на ординаті– 1°К: 5см). З’єднані точки дадуть дві нахилені прямі для попереднього та заключного періодів. Їх продовжити вправо та вліво відповідно і через середину головного періоду провести пряму, паралельну до вісі ординат, до перетину її з продовженнями попередніх прямих. Відстань між точками перетину відповідає зміні температури при розчиненні солі.
12.Визначивши з графіка Δt1, розрахувати сталу калориметра (К):
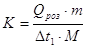
де Qроз- теплота розчинення солі ( -35,62 кДж/моль для KNO3);
m - маса нітрату калію;
М - молярна маса KNO3 (101,1 г/моль );
Δt1- зміна температури при розчиненні солі.
Дослід 2. Визначення теплоти розчинення кристалогідрату (СuSО4•5Н2О)
1. Аналогічно до попереднього досліду зважують близько 5-7 г подрібненого мідного купоросу та вміщують його в пробірку, дані зважування заносять до таблиці 1.
2. Проводять вимірювання у відповідності до п.п. 6-10 попереднього досліду. Результати заносять в таблицю 2; будують графік, за яким визначають зміну температури при розчиненні солі (Δt2)
3. Визначають теплоту розчинення (Q1) солі за формулою:
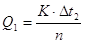 ,
,
де n - кількість речовини СuSО4•5Н2О.
Дослід 3. Визначення теплоти розчинення безводної солі (СuSО4)
1. Беруть наважку безводного сульфату міді масою 4-5г і проводять дослід аналогічно до попереднього. Дані заносять в таблицю 2. Будують відповідний графік і знаходять зміну температури при розчиненні безводної солі (Δt3).
2. Визначають теплоту розчинення (Q2) солі за формулою:
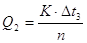 ,
,
де n - кількість речовини СuSО4.
3. Визначають теплоту утворення кристалогідрату (Q3) з безводної солі:
Q3 = Q2 – Q1
4. Розрахувати відносну похибку експерименту, якщо інтегральна теплота розчинення безводної солі +39,04кДж/моль, а кристалогідрату - рівна -11,72кДж/моль.
5. Результати всіх дослідів занести в таблиці 1 та 2.
6. Зробити відповідні висновки.
Результати роботи:
Дослід 1. Визначення сталої калориметра
1. Розрахунок маси наважки солі KNO3:
Таблиця 1.1
| Пробірка з сіллю, г | 22,33 |
| Пуста пробірка, г | 17,50 |
| Сіль, г | 4,83 |
2. Температурні показники для розчину солі KNO3:
Таблиця 1.2
| Температура | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| до розчинення | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 | 24,10 |
| після розчинення | 22,25 | 22,25 | 22,25 | 22,25 | 22,26 | 22,26 | 22,26 | 22,28 | 22,28 | 22,29 |
3. Розрахунок сталої калориметра:
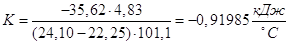
Дослід 2. Визначення теплоти розчинення кристалогідрату (СuSО4•5Н2О)
1. Розрахунок маси наважки солі СuSО4•5Н2О:
Таблиця 2.1
| Пробірка з сіллю, г | 23,50 |
| Пуста пробірка, г | 17,50 |
| Сіль, г | 6,00 |
2. Температурні показники для розчину солі СuSО4•5Н2О:
Таблиця 2.2
| Температура | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| до розчинення | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 | 23,90 |
| після розчинення | 23,73 | 23,70 | 23,70 | 23,70 | 23,70 | 23,70 | 23,70 | 23,70 | 23,70 | 23,70 |
3. Розрахунок теплоти гідратації солі СuSО4•5Н2О:
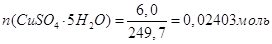 ;
;
$IMAGE6$
Дослід 3. Визначення теплоти розчинення безводної солі (СuSО4)
1. Розрахунок маси наважки солі СuSО4:
Таблиця 3.1
| Пробірка з сіллю, г | 22,00 |
| Пуста пробірка, г | 17,50 |
| Сіль, г | 4,50 |
2. Температурні показники для розчину солі СuSО4:
Таблиця 3.2
| Температура | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| до розчинення | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 | 23,98 |
| після розчинення | 24,68 | 24,70 | 24,70 | 24,70 | 24,70 | 24,70 | 24,65 | 24,65 | 24,65 | 24,65 |
3. Розрахунок теплоти гідратації солі СuSО4:
$IMAGE7$;
$IMAGE8$
4. Визначення теплоти утворення кристалогідрату з безводної солі:
$IMAGE9$
5. Розрахунок відносної похибки досліду:
$IMAGE10$
$IMAGE11$
$IMAGE12$
$IMAGE13$
Висновок:
В процесі виконання роботи ми познайомились з калориметричним методом вимірювання теплових ефектів, визначили теплоти розчинення безводного купрум (II) сульфату і мідного купоросу, визначили теплоту утворення кристалогідрату СuSО4•5Н2О з безводної солі.
$IMAGE14$
$IMAGE15$
$IMAGE16$