(В)=mB/nэкв(В) MB=mB/nB
MB=mФ.Е.*NA Mэкв(В)=М(В)/Z(B)
Закон Авогадро
V1=V2 то m1/m2=M1/M2
Закон эквивалентов
ma/mв=Мэк(А)/Мэк(В)=(М(А)/za)/(M(B)/zв)
Концентрация
1.Массовая доля w=mВ/mР=mв/Vр*rр
2.Молярная концентрация СВ=nВ/VР Сэкв(В)=nЭКВ/VР
3. Моляльная концентрация m=nB/mp-ля
4. Титр Т=mB/VP
5. Молярная доля XB=nB/å(nA+nB+…) Xi=ni/åni
Н-энтальпия S-Энтропия G-энергия Гиббса
Основные законы термодинамики
Q=êU+W при p=const Qp=êU+pêV
QP=ê (U+pV) U+pV=H QP=êH
êrH=åHK-åHH êrH-энергетический эффект хим р-и
êrH>0 поглощение êrH<0 выделение экзотермическое
тепловой эффект образования êFH и сгорания êСH
C(K)+O2(Г)=CO2 êrH=êFH(CO2)
CH4(Г)+2O2(Г)=СО2(Г)+2H2O êrH=êcH(CH4)
Стандартные условия Т=298,15К Р=101325 Па
Закон Гесса
Тепловой эффект химической реакции при V или Р =const
не зависит от промежуточной стадии.
Термохимические ур-я можно «+» или «-».
Следствия:
1) Суммарный тепловой эффект циклического пр-са=0
2) êrH=åêFH(K)-åêFH(H) 3) êrH=åêCH(H)-å êCH(K)
êrS=åS(K)-åS(H) S=RlnW
Энергия Гиббса-Гельмгольца
G=H-TS êG=êH-TêS - êG=Wmax G-энергия Гиббса,
W-работа êG=0 – состояние равновесия
Химическое равновесие с точки зрения термодинамики
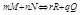
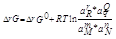
a-любая кроме равновесной актив. i-го комп-та
Па(к)/Па(н)=Ка Ка-const хим. равовесия.
Пс(к)/Пс(н)=Кс – концентрационная
Па(к)/Па(н)=К(каж) êrG0=-RTlnKa
V=KCACB2 C-молярная концентрация
[A]-ф-ла в-ва V=K[A][B]2 V-скорость Если в газе V=KPAPB2
Коэффициент Вант-Гоффа.
 если конц. то вместо V®К если
если конц. то вместо V®К если

Уравнение Аррениуса lnK= - Ea/RT+C 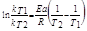
Химическое равновесие кинетический подход
 $IMAGE7$ E=hn
$IMAGE7$ E=hn
Общие cв-ва растворов
РА=Ра*ХА, ХА=(1-ХВ), VU=KUSXA $IMAGE8$
2й Закон Рауля
$IMAGE9$, $IMAGE10$
$IMAGE11$, $IMAGE12$
ПОСМ=СmRT
Р-ры электролитов
i-изотонический коэф. Pосм=iC(B)RT êT=iKCm(B) êTкип=iECm(B)
a=(i-1)/(n-1) KD=Ca2/(1-a) Закон Освальда
aH+>10-7 aOH-<10-7 – кислая Кг=Ка*аН2О Кг-const диссоц.
Количественные характеристики ОВР
Мэк. окисл.=Мок/Zприс. êЕ0=Е0ок-Е0ок êG0=-nFêE0 êE0>0-возмож.
Равновесие на границе раздела фаз.
$IMAGE13$ $IMAGE14$ - Нерст