ГОУ ВПО “ЧЕЛЯБИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ”
Химический факультет
Кафедра аналитической и физической химии
Курсовая работа:
РАВНОВЕСНЫЕ И ПОЛЯРИЗАЦИОННЫЕ ДИАГРАММЫ ПОТЕНЦИАЛ-pH
Челябинск 2010 г.
ВВЕДЕНИЕ
В настоящее время большую важность имеет возможность оценивать устойчивость металлов и их сплавов к коррозии в тех или иных условиях. Эту возможность позволяет реализовать на практике применение равновесных и поляризационных диаграмм в координатах потенциал – pH.
На основе диаграмм электрохимической устойчивости (равновесных диаграмм потенциал – pH или диаграмм Пурбе) можно делать выводы о возможности устойчивости металлов и их сплавах, условиях образования пассивирующей пленки, появлении питтингов и перехода металла в ионы.
Однако, у диаграмм Пурбе есть недостаток, заключающийся в том, что в реальности состояние электрохимического равновесия не достигается.
Для того, чтобы описать коррозионно-электрохимическое поведение металлов в реальных условиях, используется поляризационная диаграмма потенциал – рН.
Поляризационная диаграмма основана на реальных поляризационных кривых и является «коррозионным паспортом» данного сплава.
Целью данной работы является изучение равновесных и поляризационных диаграмм потенциал – pH, принципах их построения и анализа, а также расчет и построение диаграммы электрохимической устойчивости для системы Cu – H2O.
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Термодинамика электрохимических систем и электродных процессов. Условная водородная шкала. Правило знаков ЭДС и электродных потенциалов. Электрохимический потенциал. Электрохимические равновесия
Пусть в электрохимической системе обратимо и изотермически протекает процесс:
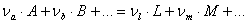 (1.1.1)
(1.1.1)
Работа по перемещению электрического заряда равна:
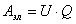 (1.1.2)
(1.1.2)
Для обратимой реакции:
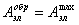 (1.1.3)
(1.1.3)
Полезная работа обратимого процесса максимальна и равна убыли изобарного потенциала системы, т. е:
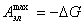 (1.1.4) при p,T=const
(1.1.4) при p,T=const
Изменение изобарного потенциала вызвано совокупностью электрохимических реакций на электродах, т. Е. суммарной химической реакцией или другими физико-химическими процессами (растворение, выравнивание концентраций, фазовое превращение и др.).
С учетом того, что U=E и 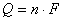 , и формул (1.1.2), (1.1.3) и (1.1.4), получаем:
, и формул (1.1.2), (1.1.3) и (1.1.4), получаем:
$IMAGE6$ (1.1.5)
Производная ΔG по температуре:
$IMAGE7$ (1.1.6)
Таким образом, измерив ЭДС системы и ее температурный коэффициент, можно легко найти величины ΔG и ΔS для суммарного процесса, протекающего в электрохимической системе. Этот процесс является самопроизвольным, следовательно, ΔG < 0.
Важную термодинамическую характеристику этого процесса – изменение энтальпии – вычисляют по уравнению Гиббса – Гельмгольца.
$IMAGE8$ (1.1.7)
$IMAGE9$ (1.8)
ЭДС электрохимической системы находят по уравнению:
$IMAGE10$ (1.9)
Чтобы связать ЭДС с константой равновесии, используют изотерму Вант – Гоффа. Если предположить, что реакция (1.1.1) протекает в жидком растворе, то:
$IMAGE11$ (1.1.10)
С учетом (1.1.5) и (1.1.10) получается:
$IMAGE12$ (1.1.11)
При $IMAGE13$получаем $IMAGE14$, где $IMAGE15$ - это стандартная величина ЭДС системы.
С учетом этого получают общее выражение ЭДС электрохимической цепи или уравнение Нернста:
$IMAGE16$ (1.1.12)
Приведенные выше уравнения дают возможность вычислить величины ΔG и К по экспериментальным значениям Е и, наоборот, рассчитать Е, зная термодинамические характеристики химической реакции.
Таким образом, измерение ЭДС электрохимических элементов и цепей является очень простым и точным методом вычисления термодинамических характеристик химических реакций и некоторых важных физико-химических процессов в растворах. Нельзя забывать, что этот метод подходит только для тех случаев, когда процесс в электрохимической системе обратим.
В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения отдельных скачков потенциала на границе раздела фаз в гальваническом элементе, значение потенциала отдельных электродов приводят относительно потенциала какого-либо стандартного электрода, потенциал которого условно принимают равным 0 при любых температурах. Таким стандартным электродом, или электродом сравнения, является обратимый водородный электрод, в котором газообразный водород находится при давлении 1 атм. и насыщает платиновый электрод. Раствор, в который погружен водородный электрод, содержит ионы водорода (гидроксония), причем активность H+ равна единице.
Согласно Международной конвенции (1953 г.), электродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева).
Например, для нахождения электродного потенциала цинка составляют элемент
(+) Pt, H2│H+, aq║Zn2+, aq│Zn (–) [1].
Пусть на границе электрод – раствор в результате протекания процессов с участием заряженных и незаряженных частиц устанавливается равновесие, описываемое уравнением (1.1).
Рассмотрим два примера установления электрохимического равновесия на границе раздела фаз.
1. Граница двух различных металлов.
При установлении равновесия на этой границе происходит выравнивание электрохимических потенциалов электронов в металлах М1 и М2.
Условие равновесия имеет вид
$IMAGE17$ (1.1.13)
$IMAGE18$ (1.1.14)
Отсюда для гальвани-потенциала на границе металл – металл получают выражение:
$IMAGE19$ (1.1.15)
Таким образом, в условиях равновесия работа перенесения электрона из одного металла в другой равна нулю, но работа переноса единицы воображаемого заряда, т. е. $IMAGE20$, отлична от нуля, поскольку химические потенциалы электрона в различных металлах неодинаковы.
2. Граница металла М с раствором, содержащим ионы этого же металла. При установлении равновесия происходит выравнивание электрохимических потенциалов ионов Mz+ в растворе и в кристаллической решетке металла.
При равновесии:
$IMAGE21$ (1.1.16)
$IMAGE22$ (1.1.17)
Гальвани-потенциал на границе металл – раствор соответствующей соли имеет вид:
$IMAGE23$ (1.1.18)
Поскольку $IMAGE24$, а $IMAGE25$, уравнение (1.1.18) можно переписать в виде:
$IMAGE26$ (1.1.19)
Уравнение (1.1.19) – это частный случай уравнения Нернста для отдельного гальвани-потенциала. Таким образом, в условиях рассмотренного электрохимического равновесия работа перенесения иона Mz+ из металла в раствор или обратно равна нулю. Гальвани-петенциал $IMAGE27$ зависит от концентрации потенциалопределяющих ионов Mz+ и также может быть сведен к нулю. Однако невозможность измерить гальвани-потенциал не позволяет установить, при какой именно концентрации Mz+ $IMAGE27$=0.
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника цепи.
Из (1.1.5):
E=–ΔG/nF (1.1.20)
Т.е. разность потенциалов на концах равновесной электрохимической цепи однозначно связана с изменением свободной энергии Гиббса в ходе соответствующей химической реакции. Величина E и называется ЭДС, т.е. электродвижущей силой электрохимической цепи. Уравнение (1.1.20) применимо только в том случае, если на всех фазовых границах устанавливается равновесие, в противном случае разность потенциалов на концах цепи не равна ЭДС и уравнение оказывается неприменимым [2].
1.2 Классификация электродов. Классификация электрохимических цепей
Классификация электродов
Классификация электродов проводится по химической природе веществ Ox и Red, участвующих в электродном процессе.
Электродом 1-ого рода называют систему, в которой восстановленной формой является металл электрода, а окисленной формой – простые или комплексные ионы этого же металла.
Примером может служить система Cu2++2e-=Cu, для которой:
$IMAGE29$ (1.2.1)
Как правило, электроды 1-ого рода обратимы по катиону, т.е. их потенциал является функцией активности катиона. Однако, есть небольшое количество электродов 1-ого рода, обратимых по аниону, например 2Te+2e-= $IMAGE30$, для которого
$IMAGE31$ (1.2.2)
К электродам 1-ого рода относятся амальгамные электроды, в которых восстановленной формой служит амальгама какого-либо металла, а окисленной – ионы того же металла:
Tl++e-(Hg)=Tl(Hg)
Поскольку в таких системах может изменяться концентрация как Ox, так и Red, то
$IMAGE32$ (1.2.3)
Здесь $IMAGE33$ - активность таллия в амальгаме.
Общая формула для потенциала электрода 1-ого рода имеет вид:
$IMAGE34$ (1.2.4)
Здесь $IMAGE35$- активность потенциалопределяющих ионов в растворе, $IMAGE36$- зарядовое число потенциалопределяющих ионов с учетом знака; $IMAGE37$- активность соответствующего металла. Для чистых металлов $IMAGE37$=const и соответствующий член $IMAGE39$ вводится в стандартный потенциал.
Электродом 2-ого рода называют систему, в которой металл покрыт слоем его труднорастворимой соли (или оксида), а раствор содержит анионы этой соли (для оксида – ионы OH-):
$IMAGE40$
Таким образом, окисленной формой здесь является труднорастворимая соль $IMAGE41$, а восстановленная форма представлена металлом $IMAGE42$ и анионом $IMAGE43$. Потенциал электрода 2-ого рода определяется активность ионов соответствующего металла $IMAGE44$, которую можно выразить через произведение растворимости соли Ls и активность аниона $IMAGE45$. Таким образом, уравнение Нернста для электродов 2-ого рода принимает вид:
$IMAGE46$ (1.2.5)
Здесь $IMAGE47$- стандартный потенциал системы Мz+/М; $IMAGE15$- стандартный потенциал электрода 2-ого рода. Как следует из уравнения (1.2.5), электрод 2-ого рода является обратимым по аниону.
Рассмотрим некоторые примеры электродов 2-ого рода.
Хлорсеребряный электрод: AgCl+e-=Ag+Cl-
$IMAGE49$ (1.2.6)
Каломельный электрод: Hg2Cl2+2e-=2Hg+2Cl-
$IMAGE49$ (1.2.7)
Ртутно-оксидный электрод: Hg2O+2e-+H2O=2Hg+2OH-
$IMAGE51$ (1.2.8)
Во всех системах, отвечающих электродам 1 и 2-ого, одним из компонентов восстановленной формы служит металл электрода. Если же инертный металл электрода не участвует в полуреакциях, а является только передатчиком электронов между Ox и Red, то такие системы называют окислительно-восстановительными электродами или редокс-системами.
Например, система:
Fe3++e-=Fe2+, $IMAGE52$
Cu2++e-=Cu+, $IMAGE53$
С платиновым электродом в качестве инертного переносчика электронов между Ox и Red.
Среди окислительно-восстановительных электродов выделяют газовые электроды. Газовый электрод состоит инертного металла (часто платины или платинированной платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь при этом на атомы, а адсорбированные атомы участвуют уже непосредственно в электродной реакции. Поскольку между молекулами газовой фазы и адсорбированными атомами устанавливается равновесие, то при записи электродного равновесия промежуточное адсорбционное состояние часто опускают. Примером газового электрода, обратимого по катиону, является водородный электрод, на поверхности которого устанавливается равновесие: H++e-=1/2H2.
Потенциал водородного электрода – это ЭДС цепи:
Pt, H2(p=1)│H3O+( $IMAGE54$=1) ¦¦ H3O+( $IMAGE54$)│ H2(p), Pt
Если в правой части цепи положить $IMAGE54$=1 и $IMAGE57$, то цепь окажется полностью симметричной и ее ЭДС должна равняться нулю. Следовательно,
$IMAGE58$ (1.2.9)
Классификация электрохимических цепей.
Электрохимические цепи обычно классифицируют по двум признакам:
1) по источнику электрической энергии
2) по наличию или отсутствию в цепи границы двух различных растворов: соответственно цепи с переносом и без переноса.
В физических цепях ис