Оксиранами (старое название эпоксиды) называют трехчленные циклические соединения, содержащие один атом кислорода в цикле.
Окись этилена
Простейший оксиран обычно называют окисью этилена. Ее получают в промышленности путем пропускания смеси этилена с воздухом или с кислородом над серебряным катализатором
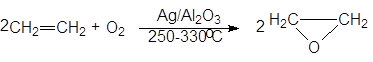 (16)
(16)
оксиран (окись этилена)
Был также разработан промышленный метод окисления одной из двойных связей бутадиена до эпоксидной группы:
 (17)
(17)
3,4-эпокси-1-бутен
Методы получения оксиранов
Окисление алкенов надкислотами
Наиболее широко используемым методом получения оксиранов является действие на алкены надкислотами:
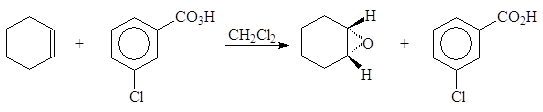 (18)
(18)
циклогексен м-хлорнадбензойная 1,2-эпоксицикло- м-хлорбензойная
кислота гексан кислота
Окисление алкенов органическими надкислотами сопровождается присоединением кислорода по двойной связи, в результате чего образуются
a-оксиды (Н.А. Прилежаев). Был предложен следующий механизм этой реакции:
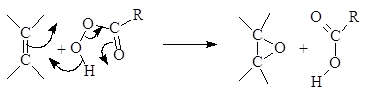 (М 5)
(М 5)
Присоединение кислорода по двойной связи в реакции эпоксидирования представляет собой син-процесс. Например, циклогексен реагирует с м-хлорнадбензойной кислотой с образованием 1,2-эпоксициклогексана:
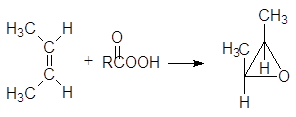 (19)
(19)
цис-2-бутен цис-2,3-диметилоксиран
(2R,3S)-2,3-диметилоксиран (мезо форма)
Эпоксид образуется той же конфигурации, что и исходный алкен:
$IMAGE6$ (20)
(2R,3R)-2,3-диметилоксиран (23,3S)-2,3-иметилоксиран
Внутримолекулярное замещение галогенгидринов
Оксираны получают также действием щелочей на галогенгидрины (вариант реакции Вильямсона):
$IMAGE7$ (21)
пропилен пропиленхлоргидрин окись пропилена
Таким путем из монохлоргидринов глицерина получают глицидный спирт, а из дихлоргидринов – эпихлоргидрин.
$IMAGE8$ (22)
монохлоргидрины глицерина глицидный спирт
$IMAGE9$(23)
аллилхлорид дихлоргидрины глицерина эпихлоргидрин
Реакции оксиранов
Эпоксиды из-за легкости раскрытия очень напряженного эпоксидного цикла чрезвычайно реакционноспособны. В общем виде реакцию можно записать так:
$IMAGE10$
где Nu = OH, OR, OAr, OOCR, Hal, NH2, NR2, SH, CN, N3 и др.
Реакция может катализироваться кислотами. Это особенно необходимо, когда раскрытие цикла осуществляется слабым нуклеофилом, например водой или спиртом:
$IMAGE11$ (24)
$IMAGE12$(М 6)
Таким образом, эпоксидирование с последующим гидролизом в присутствии кислоты является методом анти гидроксилирования алкенов. Напомним, что син гидроксилирование алкенов осуществляется окислением разбавленным раствором перманганата калия.
Катализирумый кислотой гидролиз 1,2-эпоксициклогексана приводит к образованию транс-1,2-циклогександиола в виде двух энантиомеров:
$IMAGE13$ (25)
1,2-эпоксициклогексан транс-1,2-циклогександиол
Присоединение хлороводорода к окиси этилена приводит к образованию этиленхлоргидрина:
$IMAGE14$ (25)
В присутствии кислот или оснований окись этилена димеризуется в
1,4-диоксан:
$IMAGE15$ (26)
1,4-диоксан
Реагируя с сероводородом, окись этилена дает тиогликоль, который далее реагирует еще с одной молекулой окиси этилена давая тиодигликоль.
Если в тиодигликоле заменить гидроксильные группы на атомы хлора то будет получен иприт:
$IMAGE16$
$IMAGE17$
Из окиси этилена и аммиака получают этаноламины:
$IMAGE18$
$IMAGE19$
При щелочном катализе не симметричный оксиран атакуется по наименее замещенному атому углерода:
$IMAGE20$
окись пропилена
$IMAGE21$
1-этокси-2-пропанол
При кислотном катализе не симметричный оксиран атакуется по наиболее замещенному атому углерода:
$IMAGE22$ (27)
2-метил-1,2-эпоксипропан 2-метокси-2-метил-1-пропанол
В протонированном эпоксиде более разветвленный атом углерода несет более положительный заряд, чем менее замещенный.
Этиленгликоль, реагируя с окисью этилена превращается в диэтиленгли-коль, триэтиленгликоль и т.д. до полимера:
$IMAGE23$
При добавлении к окиси этилена следов воды образуется полимер:
$IMAGE24$
Аналогичным образом окись этилена реагирует со спиртами:
$IMAGE25$ $IMAGE26$ (28)
Целлозольвы далее, могут реагировать еще с одной молекулой окиси этилена давая карбитолы:
$IMAGE27$ (26)
$IMAGE28$Взаимодействие оксиранов с магнийорганическими соединениями следует рассматривать как бимолекулярное нуклеофильное замещение у насыщенного атома углерода оксирана под действием карбаниона металлоорганического соединения.
Оксирановый цикл раскрывается также под действием диалкилкупратов, причем замещение происходит при наименее замещенном атоме углерода:
| | | | | |
| | $IMAGE31$ |
| | | $IMAGE32$ |
| $IMAGE33$ |
|
(27)