Санкт-Петербургский Государственный Университет
Химический Факультет
Курсовая работа по органической химии
Тема: Методы синтеза хинолинов и изохинолинов
Работу выполнила:
студентка 3-го курса Бутаева Е.В.
Работу проверил: Новиков М.С.
Санкт-Петербург
2008
Введение
Хинолин - гетероциклические соединение, в котором бензольное кольцо аннелировано с пиридином через атомы углерода. Соединение первоначально было выделено из каменноугольной смолы. Хинолиновая циклическая система широко распространена в природе. Алкалоид хинин, традиционно использующийся в качестве противомалярийного средства, также обладает тонизирующим эффектом. Хннолиновый скелет в течение длительного времени служил основой для поиска синтетических противомалярийных препаратов. Один из таких препаратов - хлорохин. Цианиновые красители также составляют значительную долю в коммерческой продукции на основе хинолинового сырья. Тетрагидропроизводное оксамнихин используется для борьбы с шистосомой, которая служит основной причиной заболеваний в тропических регионах. После модификации молекулы хинолина (или нафтиридина) путем введения в нее атома фтора появились антимикробные препараты с уникальными свойствами, которые получили обобщенное название "фторхинолоны". В настоящее время группа фторхинолонов по количеству современных антимикробных лекарственных средств уступает только -лактамным антибиотикам. Большая номенклатура препаратов группы фторхинолонов свидетельствует об их значении для лечения бактериальных инфекций. В настоящее время фторхинолоны занимают одно из ведущих мест в химиотерапии инфекций различного генеза и локализации.
После появления первого фторхинолона (норфлоксацин) были синтезированы многочисленные соединения этого ряда и значительная часть из них (около 15 препаратов) дошла до клинического использования, однако не все из них получили широкое применение.
Опийный алкалоид папаверин обладает способностью расслаблять гладкую мускулатуру и расширять сосуды.
Существует также несколько других семейств изохинолиновых алкалоидов, которые часто встречаются в растениях, произрастающих в Великобритании; предшественником всех этих соединений в природе служит тирозин.
Глава I
Хинолины
Большинство синтезов, ведущих к образованию хинолиновой циклической системы, состоит в замыкании пиридинового цикла по одному из четырёх возможных путей:
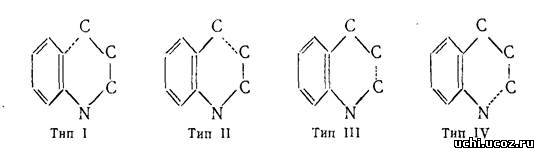
Образование связи по типу I
1. Синтез Дебнера-Миллера
Представляет собой наиболее общий метод из методов типа I.
В синтезе Дёбнера-Миллера используют α,β-ненасыщенные альдегиды и кетоны. Это существенно расширяет возможности метода при синтезе различных производных хинолина, содержащих заместители в пиридиновом кольце. В качестве конденсирующего агента используется НС1 и ZnCl2. В этом варианте синтеза также необходима стадия окисления дигидрохинолина (дегидрирование происходит за счет переноса водорода к основанию Шиффа, присутствующему в реакционной среде).
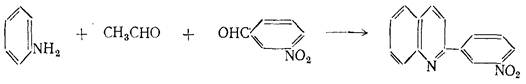
Было показано,что эта реакция применима почти для всех ароматических аминов. В качестве альдегида может быть взят любой α,β-ненасыщенные альдегид, подобный кротоновому или коричному. Общее течение реакции изображается схемой:

Применение метода Дёбнера-Миллера в случае смеси альдегидов, очевидно, ограничено реакциями конденсации, протекающими преимущественно в одном направлении. Таким образом, большинство синтезов, в которых применяется смесь альдегидов, осуществлено с ароматическими и жирными альдегидами. В этом случае преобладает одно направление конденсации. В качестве примера можно привести конденсацию с участием уксусного альдегида и м-нитробензальдегида:
2. Синтез Скраупа - конденсация ариламинов с α,β-непредельными карбонильными соединениями.
Этот синтез подбно синтезу Дёбнера-Миллера протекает через стадию образования дигидрохинолинового производного. Различие методов состоит в применении разных реагентов, при помощи которых завершается дигидрирование промежуточного продукта, дигидрохинолина, в хинолин. В методе Дёбнера-Миллера таким реагентом является образующееся из первоначально взятых веществ шиффово основание, которое способно присоединять водород и тем самым завершить дегидрирование. В реакции Скраупа дегидрирование завершается при помощи специально прибавляемого реагента.
По методу Скраупа ароматический амин, по меньшей мере с одним свободным орто-положением по отношению к амино группе, нагревается с глицерином, серной кислотой (которая действует как дегидратирующий агент и катализатор) и окислителем. В простейшем случае, когда в качестве амина взят анилин, а в качестве окислителя-нитробензол, реакцию можно изобразить следующей схемой:

Дегидратация глицерина приводит к образованию а,β-непредельного альдегида -акролеина. В дальнейшем, по-видимому, происходит присоединение анилина по Михаэлю к активированной двойной связи акролеина. Последующее электрофильное замыкание цикла требует кислотного катализа. Для окисления образующейся гидрированной структуры используют нитробензол того же строения, что и исходный анилин. Реакция сильно экзотермична, поэтому обычно добавляют замедлитель процесса - сульфат железа(П).
Как и в реакции Дебнера-Миллера, здесь может образоваться промежуточное шиффово основание. Это ни в коей мере не может отразиться на течении реакции, так как первичным продуктом циклизации является дигидрохинолин. Совершенно несущественно, как он образуется: в результате внутримолекулярного отщепления воды или анилина.
Этим методом нельзя синтезировать соединения, содержащие группировки, чувствительные к действию кислот. Это единственное ограничение данного метода, являющегося лучшим способом синтеза хинолинов, не замещённых в гетероциклическом кольце.
$IMAGE6$
3. Синтез Комба - конденсация ариламинов с 1,3-дикарбонильными соединениями
Конденсация 1,3-дикарбонильного соединения с ароматическим амином даёт с высоким выходом β-аминоенон, который циклизуется под действием концентрированной кислоты. Эта стадия представляет собой электрофильное замещение мезомерного О-протонированного аминоенона, а последующее отщепление молекулы воды приводит к образованию ароматического хинолина.
$IMAGE7$
4. Синтез Конрада-Лимпаха-Кнорра — конденсация ариламинов с β-кетоэфирами
Этот близкий предыдущему метод основан на конденсации ариламинов с β-кетоэфирами и приводит к хинолонам. В кетоэфирах имеются карбонильные группы двух типов и аминогруппа ароматических аминов конденсируется с наиболее активной карбонильной группой кетона. Полученный β-аминоакриловый эфир при 250 С циклизуется в 4-хинолон.
$IMAGE8$
Интересно отметить, что при использовании ацетоуксусного эфира в зависимости от условий реакции могут образовываться 2-метилхинолоны-4 или 4-метилхнолоны-2. Атака аминогруппы по кетонному карбонилу (образование 2-метилхинолонов-4) кинетически контролируемый процесс, который протекает при низких температурах
(~ 20°С). Атака по сложноэфирной группе предпочтительна термодинамически и происходит, когда реакцию ведут при 110-140°С (образование 4-метилхинолона-2). Полученный продукт конденсации циклизируется с образованием изомерного 2-хинолона. Таким образом этот синтез позволяет контролировать направление циклизации.
$IMAGE9$
50%
Образование связи по типу II
1. Синтез из орто-ациланилинов и карбонильных соединений, содержащих
α- метиленовую группу (синтез Фридлендера).
Хинолины можно получить конденсацией орто-ациланилинов с кетонами или альдегидами(последние должны содержать α-метиленовую группу), катализируемой кислотами или щелочами. Формально такого типа конденсация заключается в образовании основания Шиффа и последующей конденсации альдольного типа с участием арильного карбонила и активной метиленовой группы.
$IMAGE10$
Из выше приведённых примеров видно, что ориентация конденсации, а следовательно, и циклизации зависит от условий реакции. В кислой среде карбонильное соединение реагирует в виде нейтрального С3-енола, в щелочной - в виде С1-енолят аниона. Аналогичные закономерности наблюдаются и при альдольной конденсации метилэтилкетона в средах различной кислотности и основности.
Поскольку орто-ациланилины труднодоступны, используют конденсацию орто-нитрокарбонильных предшественников с активными метиленовыми компонентами с последующей восстановительной циклизацией.
$IMAGE11$
$IMAGE12$
2.Синтез Пфитцингера
Предыдущий синтез основан на применении малодоступных орто-бензальдегидов, и в этом варианте метода Фридлендера вместо них используют гораздо более доступные замещённые изатины.
Синтез Пфитцингера заключается в щелочным гидролитическом раскрытии пятичленного кольца изатина и последующей конденсации образующегося аниона орто-аминофенилглиоксиловой кислоты с кетонами. Исходный изатин легко и высокими выходами на всех стадиях можно получать из доступных реагентов:
$IMAGE13$
$IMAGE14$
3.Конденсация орто-нитроарилбензилсульфонов с эфирами малеиновой или фумаровой кислот
Исходные орто-нитробензиларилсульфоны очень удобно получать по реакции викариозного нуклеофильного замещения. Наличие в исходных структурах сульфонильной группы, обладающей способностью легко элиминироваться в виде арилсульфоновой кислоты, позволяет сразу получать ароматические структуры, не прибегая к дополнительному окислению. Процесс идет через несколько стадий и завершается образованием N-оксида 2,3-ди(этоксикарбонил)хинолина.
$IMAGE15$
Образование связи по типу III
1. Реакция Бунзла
Реакция, при которой в качестве конечного продукта образуется хинальдин:
$IMAGE16$
При нагревании N-ацетиэтиланилина с хлористым цинком наряду с пара-этилацетанилидом образуются небольшие количества хинальдина. Течение реакции может быть уяснено, если допустить, что под влиянием хлористого цинка происходит мигрирование этильной группы в соединении:
$IMAGE17$
частично в орто- и частично в пара-положение. N-ацетилметиланилин в аналогичной реакции даёт хинолин. Образование хинолина в этой реакции нельзя объяснить таким же образом, как и образование хинальдина в приведённой выше реакции. Было высказано предположение, что образование хинолина может происходить через стадию получения 2-метилиндола.
$IMAGE18$
Образование связи по типу IV
1. Реакция Чиоза
Это одна из первых известных реакций замыкания хинолинового цикла, которая заключается в образовании карбостирила при восстановлении о-нитрокоричной кислоты:
$IMAGE19$
Вместо гидросульфида аммония в качестве восстановительного агента может быть применена гидроокись двухвалентного железа.
2. Синтезы на основе превращений этилового эфира о-нитрокоричной кислоты
$IMAGE20$
Глава II
Изохинолины
$IMAGE21$
Стратегии построения изохинолинового скелета:
$IMAGE22$
C(1)-N
$IMAGE23$
C(ia)-C(i) С(4)-С(4а)
Образование связи C(1)-N Циклизация 2-цианобензилцианидов под действием галогенводородных кислот
Этот региоселективный синтез изохинолинов идет по механизму динитрильной конденсации под действием НВг или HI (применение НС1 неэффективно).
$IMAGE24$
Образование связи C(1)-C(1a)
1. Синтез из активированных фенилэтиламинов с формальдегидом (синтез Пикте-Шпенглера)
Образующиеся при взаимодействии фенилэтиламинов с альдегидами альдимины в кислой среде электрофильно циклизуются по бензольному кольцу с образованием 1,2,3,4-тетрагидроизохинолинов. Для успешного осуществления циклизации бензольное кольцо должно быть активировано к электрофильной атаке наличием электронодонорных заместителей, поскольку образующиеся при действии кислоты на имины иминиевые соли - достаточно слабые электрофилы.
$IMAGE25$
Циклизация успешно идет при наличии донорных заместителей в пара-положении к месту атаки, если такие заместители расположены в других положениях бензольного кольца реакция не идет.
$IMAGE26$
2. Циклизация ацилированных фенилэтиламинов (синтез Бишлера-Напиральского)
Ацилированние фенилэтиламинов с последующей циклизацией под действием кислот Льюиса (Р2О5, PCl3, PCl5) приводит к 3,4-дигидроизохинолинам, легко дегидрирующимся в ароматические структуры. Циклизация в этом случае - обычный электрофильный процесс, поэтому она плохо идет при наличии в бензольном кольце электроноакцепторных заместителей.
$IMAGE27$
Из мета-замещенных фенилэтиламинов образуются только 6-изомеры, то есть циклизация идет исключительно в пара-положение по отношению к заместителю.
$IMAGE28$
При наличии электроноакцепторных заместителей в ядре даже в очень жестких условиях образуются лишь следы продукта циклизации:
$IMAGE29$
Образование связи(С4-С4а)
1. Синтез Померанца-Фрича — получение изо