ЗМІСТ
ОСНОВНІ УМОВНІ ПОЗНАЧЕННЯ
ВСТУП
1. ТЕОРЕТИЧНА ЧАСТИНА
1.1 Методи дослідження рівноваги в гетерогенних системах
1.1.1 Основні положення
1.1.2 Система Р – Т
1.1.3 Система Г – Р
1.1.4 Система Г-Р-Т
1.1.5 Система Г-Т
1.2 Дослідження кінетики масообміну
1.2.1 Специфіка вивчення кінетики хімічних реакцій
1.2.2 Методи вивчення кінетики гетерогенно-каталітичних реакцій (системи Г-Т і Р-Т)
1.2.3 Основи формальної кінетики. Швидкість хімічної реакції
1.2.4 Кінетична модель топохімічних реакцій
1.3 Методи розрахунків
1.3.1 Інтегральні методи розрахунку кінетичних констант
1.3.1.1 Одинична реакція першого порядку
1.3.1.2 Одинична реакція другого порядку
1.3.1.3 Одинична реакція n-го порядку
1.3.1.4 Метод графічної інтеграції
1.3.1.5 Метод постійних частин
1.3.2 Оцінка застосовності теоретичних рівнянь
1.3.3 Розрахунок енергії активації
2. ПРАКТИЧНА ЧАСТИНА
2.1 Постановка завдання
2.2 Виконання завдання
ВИСНОВОК
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
гетерогенна кінетика хімічна реакція
ОСНОВНІ УМОВНІ ПОЗНАЧЕННЯ
V - швидкість реакції;
C– концентрація регента;
τ – час;
k – константа швидкості реакції;
K - коефіцієнт масопередачі;
F - поверхня розділу фаз;
ΔC - рушійна сила процесу;
N – кількість речовини;
β– ступінь перетворення;
τ1/2 - час напівперетворення;
α – ступінь напівперетворення;
Е – енергія активації.
ВСТУП
Курсова робота на тему «Методи експериментальних досліджень і розрахунків кінетики хіміко-технологічних процесів» з дисципліни «Хімічна технологія неорганічних речовин».
Курсова робота виконується з метою засвоєння на практиці основних методів дослідження стану рівноваги і кінетики хіміко-технологічних процесів, основ розрахунку кінетичних констант, визначення механізму і області протікання процесів.
Вивчення даної дисципліни ґрунтується на знаннях, одержаних при вивченні таких дисциплін: загальна і неорганічна хімія, фізична хімія, фізика, вища математика, теоретичні основи технології неорганічних речовин, кінетика і каталіз, основи наукових досліджень і наукова інформація і інших.
Мета і задачі курсової роботи:
- засвоєння на практиці основних методів дослідження стану рівноваги і кінетики хіміко-технологічних процесів;
- засвоєння основ розрахунку кінетичних констант;
- визначення механізму і області протікання процесів.
1. ТЕОРЕТИЧНА ЧАСТИНА
1.1 Методи дослідження рівноваги в гетерогенних системах
1.1.1 Основні положення
Інформація про рівновагу є первинною при створенні технологічного процесу. В гомогенних системах, термодинаміка яких детально розроблена, вона може бути одержана і розрахунковим шляхом за методами які розглядаються в курсах «Фізична хімія» та «Теоретичні основи технології неорганічних речовин». В гетерогенних системах її дуже часто визначають тільки дослідним шляхом.
Для дослідження рівноваги в гетерогенних системах використовують дві групи базових методів: статичні і динамічні. В статичних методах завантажені в реактор реагенти витримують до встановлення рівноваги, не обновлюючи. Динамічні методи, або проточні - це методи з реагентами, які в ході досліду вводять в реактор і виводять з нього, замінюючи свіжими. Широке поширення набули також комбіновані методи: статичні по одній фазі (наприклад, по рідкій) і динамічні по іншій (наприклад, по газу). В циркуляційних методах динамічний принцип роботи поєднується з відсутністю введення свіжих реагентів, що характерне для методів статичних. Вони, отже, є варіантом статичного методу. Схемне зображення методів, вживаних при вивченні гетерогенної рівноваги, приведено на рис.1.
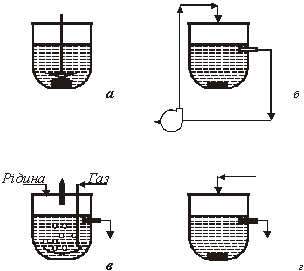
Рис. 1. Схематичне зображення методів:
а – статичний метод;
б – метод статичний з зовнішньою циркуляцією однієї з фаз (циркуляційний); в – динамічний метод;
г – комбінований метод (проток однієї з фаз відсутній)
Збільшенню швидкості перебігу процесу сприяє диспергування і перемішування фаз. Обидва прийоми підвищують швидкість перенесення компонентів системи до поверхні розділу фаз. Диспергування припускає попереднє подрібнення частинок твердої фази і введення газу в рідину через дисперсійні перегородки (наприклад, фільтр Шотта). Можливості диспергування небезмежні, і в лабораторних умовах одержати пил або міхур газу розміром істотно нижче 0,1 мм важко. Принципи перемішування очевидні з рис.1: мішалка (а), циркуляція (б), протока (в, г).
Диспергування і перемішування – це, у відомому значенні, турбування експериментатора про самого себе: чим вище швидкість встановлення рівноваги, тим швидше буде завершений дослід. Контроль перебігу процесу в часі - це борг експериментатора. Але, без "виплати" його немає, і не може, бути вивчення рівноваги, оскільки не яке окреме вимірювання виконане через будь-який, навіть дуже значний, проміжок часу після початку досліду, не має в собі самому ознаки рівноваги. Воно одержує це через зіставлення з іншими вимірюваннями, у тому числі, з вимірюваннями, що здійснені через інші (і великі, і менші) проміжки часу.
У багатофазній системі число ступенів свободи, що визначають стан рівноваги, дається рівнянням Гиббса - Дюгема:
У = К - Ф+2
де: У - число ступенів свободи
К - кількість компонентів
Ф - число фаз
2 – ступені свободи, що доводяться на "постійні" термодинамічні параметри: температуру і тиск.
Це ж рівняння, по суті, визначає кількість незалежних змінних в дослідах по вивченню рівноваги. Наприклад, для чотирьох компонентів, що відповідає реакції:
А + В « С + Д
і двох фаз кількість незалежних змінних рівна чотирьом. До них слід віднести температуру, тиск і концентрації двох будь – яких компонентів. Цю сукупність змінних позначають через Т, Р і Сij (i - номер компоненту, j - номер фази) і називають термодинамічними параметрами системи. Кожний дослід по вивченню рівноваги здійснюють в деякій точці багатовимірного простору, утвореного цими параметрами. Рухаючись по ньому з вибраною стратегією (наприклад, відповідно до правил статистичного планування, які розглядаються в курсі “Математичне моделювання і застосування ЕОМ”), дослідник здійснює більш менш повне вивчення об'єкту. Нижче розглядається техніка вивчення гетерогенної рівноваги в системах, що найбільш часто зустрічаються в неорганічній технології. Фази систем позначені заголовними буквами: Г - газ, Р - рідина, Т - тверде тіло.
1.1.2 Система Р – Т
Набір термодинамічних параметрів в цій системі рівний двом найменуванням: Т і Cij (оскільки Сij – може бути набагато більше ніж 1, то говорити про два параметри не можна). Тиск виключений. Він пов'язаний з газовою фазою, яка за умов задачі неістотна. Область зміни температур в технології неорганічних речовин практично обмежується температурами замерзання і кипіння води (або іншого розчинника). Область зміни концентрацій речовини, що розчиняється, обмежується з одного боку нулем (немає речовини в розчині) з другого боку – концентрацією насиченого розчину при заданій температурі (речовина перестає розчинятися). Отже,
Т, Р, Cij ®Т (0 ÷ 100 0С), Cij (0 ÷ Снас).
Транспорт твердого матеріалу, як правило, ускладнений. В лабораторних умовах використання великих кількостей рідкої фази (водні розчини кислот, солей і лугів) небажане. Сукупність всіх цих обставин призводить до того, що найпереважнішим типом реактора є статичний, схема якого була приведена на рис.1. Він є термостатованою відкритою колбою або стаканом. Реактор обов'язково обладнають мішалками.
У реактор послідовно завантажують твердий матеріал і рідину, включають мішалку і ведуть відлік часу, періодично відбираючи на аналіз рідку фазу. В ході проміжних аналізів звичайно визначають зміст тільки ключового компоненту. Як ключовий компонент, непридатна речовина, що знаходиться в системі у великому надлишку - його концентрація змінюється мало. В цій же якості незручна речовина, концентрація якої дуже низька, оскільки її визначення звичайно ускладнене. Як ключову слід вибирати речовину, для якої зміни концентрації визначаються легко і точно.
Якщо передбачений фізико–хімічний аналіз, то пробу після визначення в ній ключового компоненту повертають в реактор. При хімічному аналізі пробу в реактор не повертають, а спад речовин, звичайно, враховують шляхом складання по-компонентних матеріальних балансів.
Після досягнення рівноваги фази розділяють. Це одна з найважчих операцій методу, особливо якщо вивчення рівноваги проводять при температурі, яка суттєво відрізняється від кімнатної. В ході фільтрації і декантації відбувається зміна температури розчину, що міняє рівноважні співвідношення. Тому ці операції проводять на фільтрах, що обігріваються (охолоджуються), і по можливості швидко. Повне розділення фаз вимагає, крім того, промивки осаду на фільтрі, що може супроводжуватися його частковим розчиненням. Підбору промивної рідини, її кількості, температурі і доцільності її приєднання до основної маси фільтрату надається особлива увага.
Фільтрат аналізують на всі компоненти системи. Аналіз твердої фази, якщо він представляє значні труднощі, в технологічних дослідах часто не проводять. Склад її розраховують на підставі матеріальних балансів компонентів в рідкій фазі.
У неорганічній технології описану вище техніку експериментатор використовує при вивченні сольової рівноваги і процесів екстракції речовин з природної сировини (наприклад, фосфорної кислоти з фосфоритів).
1.1.3 Система Г – Р
Число найменувань термодинамічних параметрів в цій системі дорівнює трьом. Інтервал температур, як і в системі Р - Т, дорівнює 0 ÷ 100°С. Тому Т, Р, Cij Т( 0 ÷ 100°C), Р(0 ÷ Рзж), Cij(0 ÷ Снас.).Інтервал по тиску у верхній межі обмежується, як правило, тиском зжиження газу, а інтервал по концентраціях – концентрацією насиченого розчину (наприклад, при її підвищенні ми можемо одержати трифазну систему, оскільки розчинена речовина почне кристалізуватися). Для вивчення рівноваги в системі Г - Р частіше за інші використовують комбінований метод: проточний по газу і статичний по рідині. Його реалізують у вигляді двох варіантів, які можна назвати методом "рівноважного тиску" і методом "рівноважних складів". В методі "рівноважного тиску" летучий компонент переходить з рідини в газову фазу так, щоб в ній досягався парціальний тиск компоненту, рівноважний складу рідини. В методі "рівноважних складів" має місце зворотний перехід. В ньому забезпечують склад рідини, рівноважний парціальному тиску компонентів газової фази.
1.1.4Система Г-Р-Т
У неорганічній технології використовують речовини, які як правило, добре змочувані водою. Тому рівновага в системі Г-Р-Т зводиться до рівноваги в двох пов'язаних між собою системах: Г-Р і Р-Т. Незалежне вивчення кожної з цих систем, якщо воно можливе, дозволяє розрахувати рівноважний стан трифазної системи. Якщо потреба в експериментах все ж таки є, то для їх виконання використовують методи, вживані в системі Г-Р; вони поєднують в собі елементи, достатні для вивчення будь-якої із зв'язаних двофазних систем. В реакторі, природньо, буде знаходиться суспензія Т в Р.
Основна складність будь – якого методу вивчення рівноваги, пов'язана з фіксацією його встановлення. В цій системі вона ускладнена тим, що швидкість встановлення рівноваги в парах, Г-Р і Р-Т може виявитися істотно різною. Аналіз на швидкому "плечі" системи може свідчити про встановлення рівноваги, яка насправді не досягнута. Тому контролю рівноваги слід надати підвищену увагу, а аналіз повинен обов'язково захоплювати фази повільного "плеча" системи.
1.1.5 Система Г-Т
Для цієї системи характерний повний набір термодинамічних параметрів, і дуже широкий інтервал їх зміни. Він майже не має обмежень для тиску. Для температури нижньою межею є абсолютний нуль, а верхнім - температура плавлення твердого тіла.
Для вивчення рівноваги в системі Г-Т широко використовують комбінований і статичний методи. Вибір методу в основному обумовлений тиском: при атмосферному і підвищеному тиску застосовують комбіновані установки, для вимірювань у вакуумі - статичні. Дані про рівновагу в системах Г-Т необхідні для створення процесів кальцинації твердих речовин і адсорбційного очищення газів. Їх використовують і при визначенні величини питомої поверхні адсорбентів і каталізаторів, при вивченні властивостей поверхні твердих тіл і структури пор в них.
1.2 Дослідження кінетики масообміну
Вивчення рівноваги дає необхідну, але для розрахунку технологічного процесу (апарату) недостатню інформацію. Процес протікає в часі, в апараті обмежених розмірів; і кінцевий стан комп