Министерство образования и науки Российской Федерации
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Федеральное государственное образовательное учреждение высшего профессионального образования
«Чувашский государственный университет им. И.Н. Ульянова»
Методические указания к практическим занятиям по физической химии:
КИНЕТИКА ХИМИЧЕСКИХ И ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
Чебоксары 2007
УДК 541.1:541.2:541.6
Составители:
С.М. Верхунов
Р.А. Зимин
Э.В. Андреева
Н.И. Кольцов
Кинетика химических и электрохимических процессов: Метод. указания к практическим занятиям по физической химии / Сост. С.М. Верхунов, Р.А. Зимин, Э.В. Андреева, Н.И. Кольцов; Чуваш. ун-т. Чебоксары, 2007. 61 с.
Содержат задачи по следующим темам: электрическая проводимость, равновесия в растворах электролитов, электродвижущие силы, электродные потенциалы, формальная кинетика, сложные реакции, зависимость скорости реакции от температуры, фотохимические реакции. К каждой теме приведены необходимые теоретические сведения, основные уравнения, методики решения задач, предложены задачи для самостоятельного решения с ответами.
Для студентов III и IV курсов химико-фармацевтического факультета.
Ответственный редактор д-р хим. наук, профессор Н.И. Кольцов
Утверждено Методическим советом университета.
1. Электрическая проводимость. Равновесие в растворах электролитов
1.1 Необходимые исходные сведения и основные уравнения
Электролитом называется вещество, которое при взаимодействии с водой способно распадаться на ионы и тем самым переносить электрический заряд. По способу переноса электрического заряда все проводники делятся на два рода. К проводникам первого рода относятся проводники с электронной проводимостью (все металлы, углерод, графит, некоторые неметаллы). К проводникам второго рода относятся проводники с ионной проводимостью (растворы кислот, большинства солей и оснований, а также их расплавы).
Важнейшей характеристикой электрической проводимости является электрическое сопротивление проводников:
R = r∙l/s,(1.1)
где r - удельное электрическое сопротивление, Ом.м; l – длина проводника первого рода или расстояние между электродами в проводнике второго рода, м; s – площадь поперечного сечения проводника первого рода или площадь электродов проводника второго рода, м2.
Величина, обратная сопротивлению, называется электрической проводимостью:
1/r = c,(1.2)
где c - удельная электрическая проводимость, Ом-1.м-1. Удельной электрической проводимостью называется электрическая проводимость электролита, заключенного между электродами площадью 1 м2 и расположенными на расстоянии 1 м друг от друга.
Для растворов электролитов часто пользуются понятием «эквивалентная электрическая проводимость» l:
l = c/с (1.3)
где с – эквивалентная концентрация электролита, моль.м-3. Эквивалентной электрической проводимостью называется электрическая проводимость электролита, заключенного между электродами, находящимися на расстоянии 1 м друг от друга и такой площади, что в пространстве между ними содержится 1 моль электролита.
Зависимость эквивалентной электрической проводимости от концентрации описывается уравнением Кольрауша:
l = l¥ - А  ,(1.4)
,(1.4)
где l¥ - эквивалентная электрическая проводимость при бесконечном разбавлении, Ом-1.моль-1.м2; А – постоянная, зависящая от природы электролита.
Так как проводник второго рода при растворении в воде распадается на два типа ионов, то электрический заряд переносится совместно катионами и анионами и справедливо уравнение Кольрауша (закон независимости движения ионов):
l¥ = l+ + l-,(1.5)
где l+ и l- - электрические проводимости соответственно катиона и аниона, Ом-1.моль-1.м2. Электрическая проводимость катиона и аниона в большей степени определяется скоростью их движения:
u+ = u+0U/l и v- = v-0U/l,(1.6)
где u+0 и v-0 – абсолютные скорости движения ионов, м2.с-1.В-1; U/l – напряженность электрического поля, В.м-1,
l+ = F.v+0 и l- = F.v-0,(1.7)
где F – число Фарадея (F = 96500 Кл).
Абсолютные скорости движения ионов различны. Так как в проводниках второго рода электрический заряд переносится од-новременно катионами и анионами, то
Q = Q+ + Q-и I = I+ + I- (1.8)
где Q – перенесенный заряд, Кл; Q+ и Q- - заряд, перенесенный катионами и анионами, Кл; I, I-, I+ - общая сила тока и сила тока, определяемая движением анионов и катионов, А.
Количество заряда, перенесенного ионами, зависит от скорости движения (подвижности), заряда и размера ионов, а также от некоторых других факторов. В большинстве случаев доли зарядов, перенесенных разными видами ионов, не совпадают друг с другом. По этой причине вводится понятие о числах переноса ионов (t+ и t-). Числом переноса ионов называется доля заряда, перенесенного данным видом иона:
t+ = Q+/(Q+ + Q-) = I+/(I+ + I-); (1.9)
t- = Q-/(Q+ + Q-) = I-/(I+ + I-). (1.10)
Очевидно, что t+ + t- = 1. Отсюда:
t+ = 1 – t- и t- = 1 – t+. (1.11)
Числа переноса можно выражать через скорости движения и подвижности ионов:
t+ = v+0/(v+0 + v-0) = λ+/(λ+ + λ-) = λ+/λ∞;
t- = v-0/(v+0 + v-0) = λ-/(λ+ + λ-) = λ-/λ∞. (1.12)
Так как в ходе переноса заряда ионы разряжаются на электродах, то концентрации электролита в анодном, катодном и среднем пространствах различны:
t+ = Δск/Δс иt- = Δса/Δс (1.13)
где Dск и Dса– изменение концентрации электролита в катодном и анодном пространствах; Dс – общая убыль концентрации элек-тролита (изменение концентрации в среднем пространстве).
Количественно степень распада электролита на ионы выра-жается через a (степень диссоциации):
a = np/n, (1.14)
где np – количество молекул, распавшихся на ионы; n – общее количество молекул электролита, введенных в раствор. По значению a различают сильные и слабые электролиты (a > 0,85 и 0,25 > a > 0,85 соответственно).
При диссоциации слабого электролита, распадающегося на одновалентные ионы по схеме: АВ ↔ А+ + В-, константа диссоциации:
Кд = [А+].[В-]/[АВ], (1.15)
где символы в квадратных скобках указывают на концентрации соответствующих веществ. Если степень диссоциации
a = [А+]/с = [В-]/с = λ/λ∞, (1.16)
то Кд = a2.с, или a = 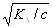 . (1.17)
. (1.17)
Соотношение (1.17) называется законом разведения Оствальда (в простейшей форме). После подстановки (1.16) в (1.17) закон разведения Оствальда примет вид
Кд = λ2. с/[(λ∞.(λ∞ - λ)]. (1.18)
Зависимость константы диссоциации от температуры описывается уравнением
lg (К 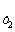 /К
/К  ) = -ΔНдисс(1/Т2 – 1/Т1)/(2,3.R), (1.19)
) = -ΔНдисс(1/Т2 – 1/Т1)/(2,3.R), (1.19)
где DНдисс– теплота диссоциации, Дж.моль-1.
Работу диссоциации можно определить по уравнению изотермы Вант-Гоффа:
w = -DG0 = RTlnKи w = -DG0 = 2,3RTlgK, (1.20)
где DG0 – стандартное изменение энергии Гиббса (изобарно-изотермического потенциала) при диссоциации, кДж.моль-1.
Необходимо учесть, что для сильных электролитов в приведенные выше уравнения вместо концентрации необходимо подставлять активности, которые связаны с концентрациями через коэффициент активности:
а = g.c, (1.21)
где а – активность сильного электролита, моль.м-3; g - коэффициент активности сильного электролита при данной концентрации, с – молярная концентрация сильного электролита, моль.м-3;
Активностью сильного электролита называется активная часть этого вещества в растворе. Коэффициенты активностей для большинства веществ известны и приведены в справочнике (например, в [8]). Активность электролитов чаще всего выражают через моляльность m и средние ионные коэффициенты активности γ±.
Таблица 1 - Соотношения между моляльностью m, средней ионной моляльностью m±, активностью а и средним ионным коэффициентом активности γ± для некоторых электролитов
| Тип валентности электролита | Пример | а = =(m±∙γ±)ν | а± = = ν 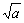 |
| 1-1, 2-2, 3-3 | KCl (1-1); ZnSO4 (2-2); AlPO4 (3-3) | m2g±2 | mg± |
| 2-1, 1-2 | CaCl2 (2-1); Na2SO4 (1-2) | 4m3g±3 |
|
|
|
|
|
|
|