Энергетика химических реакций
I. Химическая термодинамика – это раздел физической химии, которая изучает превращения различных видов энергии при химических реакциях, процессах растворения, кристаллизации. Химическая термодинамика исследует возможности и границы самопроизвольного протекания физических процессов. Объектом изучения в термодинамике является термодинамическая система, под которой понимают условно выделенную из пространства совокупность тел, между которыми возможен масса- и теплообмен.
Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми.
Если между средой и системой отсутствует и тепло- и массообмен – это изолированная система.
Различают также гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные.
Совокупность свойств системы называется состоянием системы. Одна и та же система может находиться в различных состояниях. Каждое состояние характеризуется определённым набором значений термодинамических параметров.
Параметры, описывающие состояние системы, называются параметрами состояния.
Они делятся на интенсивные и экстенсивные. Интенсивные не зависят от размера системы, а зависят от температуры и давления, экстенсивные зависят от массы и объёма. Изменение одного из параметров приводит к изменению состояния в целом.
Состояние системы называется равновесным, если параметры системы во времени самопроизвольно не изменяются. Неравновесная система – параметры во времени изменяются.
Состояние системы и происходящие в ней изменения определяются так же с помощью функций состояния. Функции состояния – внутренняя энергия, энтропия, изобарный, изотермический потенциал.
Переход системы из 1-го состояния во 2-ое называется процессом.
1.  – изотермический процесс
– изотермический процесс
2. 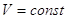 – изохорный процесс
– изохорный процесс
3. 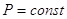 – изобарный процесс
– изобарный процесс
Основной функцией состояния системы является её полная энергия, которая является суммой 3-х состояний: 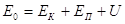 кинетическая энергия движущейся системы, потенциальная энергия обусловленная воздействием на систему внешних силовых полей, внутренняя энергия.
кинетическая энергия движущейся системы, потенциальная энергия обусловленная воздействием на систему внешних силовых полей, внутренняя энергия.
При термодинамическом описании системы 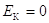 , $IMAGE6$; $IMAGE7$ и включает в себя энергию всех форм движения молекул, атомов, электронов; энергию межмолекулярного взаимодействия; внутреннюю атомную и внутреннюю ядерную энергию.
, $IMAGE6$; $IMAGE7$ и включает в себя энергию всех форм движения молекул, атомов, электронов; энергию межмолекулярного взаимодействия; внутреннюю атомную и внутреннюю ядерную энергию.
Экспериментально внутреннюю энергию $IMAGE8$ определить нельзя, можно определить лишь её изменение $IMAGE9$: $IMAGE10$.
II. Если система обменивается с внешней средой тепловой энергией $IMAGE11$ и механической энергией (работой) $IMAGE12$ и переходит из 1-го состояния во 2-ое, то согласно 1-му началу термодинамики – количество энергии, которое выделяется или поглощается системой в виде теплоты $IMAGE11$ и работы $IMAGE12$, равно изменению полной энергии системы $IMAGE9$, т.е. при переходе из 1-го состояния во 2-ое: $IMAGE16$.
Для изохорного процесса (при 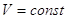 ) тепловой эффект реакции при температуре T соответствует изменению внутренней энергии системы в ходе реакции: $IMAGE18$.
) тепловой эффект реакции при температуре T соответствует изменению внутренней энергии системы в ходе реакции: $IMAGE18$.
Для изобарного процесса ( 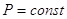 ):
):
$IMAGE20$, следовательно
$IMAGE21$ или $IMAGE22$, откуда получаем
$IMAGE23$.
Функция $IMAGE24$ обозначается через $IMAGE25$ и называется энтальпия.
Энтальпия – есть функция состояния системы, имеет размерность энергии.
$IMAGE26$
III. Сущность химических реакций сводится к разрыву связей в исходных веществах и образованию связей в продуктах реакции. Т.к. образование связей протекает с выделением энергии, а разрыв с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Раздел термодинамики, который изучает тепловые эффекты химических реакций, называется термохимией.
Энергия, которая выделяется и поглощается, называется тепловым эффектом химической реакции.
Если прочность связей в продуктах реакции больше чем в реагентах, то выделяется энергия в виде теплоты $IMAGE11$.
Процессы, протекающие с выделением теплоты называются экзотермическими, а с поглощением – эндотермическими.
Тепловой эффект эндотермической реакции считают положительным «+» (поглощение тепла), а экзотермической – отрицательным «−» (выделение тепла).
Тепловой эффект в изобарных условиях определяется изменением энтальпии $IMAGE28$, в изохорных условиях – изменением внутренней энергии $IMAGE9$, т.е. для экзо- $IMAGE30$, $IMAGE31$, для эндо- $IMAGE32$, для $IMAGE33$.
Величины $IMAGE28$ и $IMAGE9$ сильно различаются только для систем, в которых вещества в газообразном состоянии.
Для систем, в которых вещества находятся в конденсированном состоянии изменение объёма в ходе реакции мало, т.е. $IMAGE36$, тогда $IMAGE37$; $IMAGE38$.
При термомеханическом описании реакции опускают 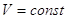 ,
, 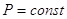 , говорят только об изменении энтальпии $IMAGE28$:
, говорят только об изменении энтальпии $IMAGE28$:
Закон Гесса: тепловой эффект химической реакции протекающий или при 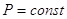 или при
или при 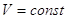 не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы.
не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы.
$IMAGE44$ $IMAGE45$
$IMAGE46$ $IMAGE47$ $IMAGE12$ $IMAGE28$ $IMAGE50$
$IMAGE51$ $IMAGE52$ $IMAGE53$
$IMAGE54$ $IMAGE55$
$IMAGE56$ $IMAGE57$
Тепловой эффект реакции зависит от природы регентов и продуктов реакции, их агрегатного состояния, условия проведения реакции, а также от количества, участвовавшего в реакции.
Поэтому тепловой эффект принято относить к 1-му моль вещества и определять его в стандартных условиях: $IMAGE58$, $IMAGE59$, $IMAGE60$.
При термохимических расчётах важными являются $IMAGE61$ ( $IMAGE62$) – это тепловой эффект реакций образования вещества из простых веществ. По величинам и знакам энтальпии можно судить об устойчивости соединения относительно его распада на простые вещества.
Если $IMAGE63$, то соединение более устойчиво, чем простые вещества, из которых оно образовано. Стандартный тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов: $IMAGE64$
$IMAGE65$
$IMAGE66$=[Дж/моль]
$IMAGE67$ – эндотермический процесс, $IMAGE68$ – экзотермический процесс
$IMAGE69$ – для простых веществ
С термохимическими уравнениями можно проводить любые математические действия.
3) $IMAGE70$
1) $IMAGE71$ $IMAGE72$
2) $IMAGE73$ $IMAGE74$
$IMAGE75$
$IMAGE76$
$IMAGE77$ – по закону Гесса
Тепловой эффект изменяется с изменением температуры в соответствии с законом Кирхгофа: $IMAGE78$,
где $IMAGE79$ – разность между ∑ теплоёмкостей продуктов реакций за вычетом реагентов.
Теплоёмкость $IMAGE11$, которая необходима для нагревания определённого количества вещества на 1К, если относится к 1 молю – молярная, к 1 кг – удельная.
при 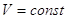 $IMAGE82$ при
$IMAGE82$ при 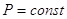 $IMAGE84$
$IMAGE84$
IV. Реакцию, идущую саму по себе (без помощи извне) называют самопроизвольной.
Некоторые самопроизвольные реакции являются эндотермическими.
$IMAGE85$ $IMAGE86$ $IMAGE86$ $IMAGE85$ $IMAGE85$ Ne Ar
Два газа разделены перегородкой, если ее убрать начнется самопроизвольный процесс взаимодиффузии. Система, состоящая из различных молекул, в разных сосудах более упорядочена, чем смесь разных молекул в одном сосуде, т.е. все самопроизвольные изменения заключаются в переходе из упорядоченного состояния частиц в менее упорядоченное. Степень беспорядка или неупорядоченность в системе характеризуется состоянием системы называемом энтропией.
Энтропия – функция меры беспорядка $IMAGE90$, она связана с термодинамической вероятностью реализации данного состояния вещества:
$IMAGE91$, где
$IMAGE92$ – постоянная Больцмана,
$IMAGE93$ – термодинамическая вероятность, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
$IMAGE94$ – стандартная энтропия, $IMAGE95$ – её изменение.
В изолированных системах изменение энтропии служит критерием определяющим направление процесса.
2-ое начало термодинамики: В изолированных системах самопроизвольно протекают те процессы и реакции, в ходе которых энтропия $IMAGE90$ возрастает.
Процессы, для которых $IMAGE97$ – расширение газов, фазовые превращения (их же в газ), процессы растворения, плавление, кипение, диссоциация соединений, нагревание.
Процессы, для которых $IMAGE98$ – сжатие газов, конденсация, кристаллизация, охлаждение.
Если в ходе реакции объём возрастает, то $IMAGE97$.
$IMAGE100$ $IMAGE101$ возрастает $IMAGE97$
В ряде однотипных соединений $IMAGE90$ возрастает по мере усложнения атомов, входящих в состав соединений: $IMAGE104$; по мере усложнения состава молекулы: $IMAGE105$.
$IMAGE106$ $IMAGE107$ $IMAGE97$, т.е. усложняется состав
В отличие от энтальпии $IMAGE25$ и внутренней энергии $IMAGE8$ для чистых веществ можно определить абсолютное значение энтропии $IMAGE90$.
Энтропия, определяемая в стандартных условиях ( $IMAGE58$, $IMAGE113$) называется стандартной $IMAGE94$.
$IMAGE115$ – для простых веществ.
Изменение энтропии $IMAGE95$ в ходе химической реакции определяется как $IMAGE117$ продуктов реакции за вычетом $IMAGE117$ исходных реагентов с учётом стехиометрических коэффициентов: $IMAGE64$
$IMAGE120$.
Изменение энтропии $IMAGE95$ в ходе реакции образования соединений из простых веществ называют энтропией образования $IMAGE122$.
$IMAGE45$
$IMAGE124$
$IMAGE125$ $IMAGE126$ $IMAGE127$
V. Только для изолированной системы, у которой нет обмена энергией с окружающей средой, энтропия является единственным фактором, определяющим возможность протекания процессов. На практике обычно системы закрытые, в которых изменяется внутренняя энергия и совершается работа против внешних сил. Для таких систем критерием направления протекания процесса является не только стремление системы перейти в состояние с наибольшей термодинамической вероятностью, но и стремление системы перейти в состояние с наименьшей энергией, т.е. выделить теплоту в окружающую среду. Стремление среды к увеличению энтропии называется энтропийным фактором. Стремление системы получить внутреннюю энергию называется энтальпийным фактором.
Суммарный эффект этих двух противоположно действующих факторов в условиях при $IMAGE128$ находит отражение в изменении энергии Гиббса $IMAGE129$ (изобарно-изотермический потенциал): $IMAGE130$ и в условиях $IMAGE131$ находит отражение в изменении энергии Гельмгольца $IMAGE132$ (изохорно-изотермический потенциал): $IMAGE133$.
Поскольку $IMAGE134$, то $IMAGE135$.
$IMAGE129$ и $IMAGE132$ являются функциями состояния системы.
$IMAGE28$ $IMAGE139$ $IMAGE139$ $IMAGE141$
$IMAGE142$ $IMAGE142$ $IMAGE9$ $IMAGE145$
$IMAGE142$ $IMAGE147$ $IMAGE147$ $IMAGE149$ $IMAGE132$ $IMAGE145$
$IMAGE152$ $IMAGE153$ $IMAGE149$ $IMAGE129$
Для процессов в конденсированных средах в ходе реакции $IMAGE36$, тогда $IMAGE157$.
$IMAGE129$ образования 1-го моль соединения из простых веществ, называется $IMAGE159$, стандартная $IMAGE160$.
Изменение энергии Гиббса $IMAGE129$ в ходе химической реакции равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса реагентов с учётом стехиометрических коэффициентов: $IMAGE64$
$IMAGE163$.
$IMAGE164$ – для простых веществ
Величина и знак $IMAGE129$ определяют возможность самопроизвольного протекания процесса.
Самопроизвольно в направлении образования продуктов реакции протекают только те реакции, в ходе которых происходит уменьшение $IMAGE129$. Реакция идёт в направлении пока $IMAGE164$ (система равновесия).
Если $IMAGE168$, то в данных условиях реакция самопроизвольно протекать не будет.
| $IMAGE28$ | $IMAGE95$ | $IMAGE129$ | Вывод |
| − | + | − | Протекает самопроизвольно при любой T |
| − | − | − + |