Принципы структурной организации мембранных белков и способы ее предсказания для трансмембранных белков
С высоким разрешением удалось установить структуру только одного класса мембранных белков – реакционного центра бактерий, однако и в этом случае положение белка относительно липидного бислоя не определено однозначно. Распространять принципы его организации на другие мембранные белки следует с осторожностью. Некоторую ясность может внести использование термодинамических принципов, а также учет того факта, что основная масса экспериментальных данных согласуется с предположением о высоком содержании в мембранных белках а-спиралей. Термодинамические факторы налагают определенные ограничения на то, какого типа белково-липидные структуры могут быть стабильными.
Мембранные белки – это амфифильные соединения
Любые мембранные белки, непосредственно контактирующие с гидрофобной сердцевиной липидного бислоя, должны быть амфифильными. Те участки полипептида, которые экспонированы в растворитель, скорее всего обогащены полярными и ионизируемыми аминокислотными остатками, а остатки, контактирующие с лилидными углеводородными цепями, должны быть в основном неполярными. Все это логически следует из энергетических принципов, рассмотренных в разд. 2.3.1. Заряженные или полярные аминокислоты вообще говоря могут находиться внутри бислоя, однако на это налагаются определенные ограничения.
Рассмотрим три уровня амфифильных структур в мембранных белках: первичную, вторичную и третичную амфифильность.
1. Первичные амфифильные структуры содержат протяженный участок из преимущественно неполярных аминокислотных остатков, длина которого достаточна для пересечения бислоя. Такие структуры выявлены как в реакционном центре, так и в бактериородопсине. У этих белков все пронизывающие мембрану элементы являются а-спиральными. а-Спиральная структура предпочтительна потому, что при этом образуются все водородные связи, в которых могут участвовать атомы водорода полипептидного каркаса. Альтернативная структура, у которой отсутствует одна из водородных связей, менее стабильна примерно на 5 ккал / моль. Все это позволяет высказать предположение о том, что поворот полипептидной цепи внутри мембраны маловероятен. В местах поворота от трех до пяти аминокислотных остатков не смогли бы образовать водородные связи, и это дестабилизировало бы структуру примерно на 15–20 ккал / моль. В глобулярных, водорастворимых белках области поворота располагаются преимущественно на поверхности белковой глобулы, где амидные группы могут образовывать водородные связи с водой; по-видимому, в молекулах мембранных белков повороты также будут происходить лишь в экспонированных в воду участках.
Не исключено, что 3-слой тоже может образовывать трансмембранные элементы, имеющие, например, форму /J-цилиндров, как в случае порина. Требования, предъявляемые к образованию водородных связей атомами водорода полипептидного остова в подобных структурах, могут быть удовлетворены, но лишь при условии взаимодействия между отдельными ^-цепями. Как такая структура может встраиваться в мембрану, не совсем ясно, а ограничения, налагаемые механизмами сборки мембранных белков, вообще неизвестны.
2. Вторичные амфифильные структуры. В таких структурах гидрофобные остатки периодически встречаются вдоль цепи, и при укладке полипептида в определенную вторичную структуру они образуют сплошную поверхность. Периодичность некоторых элементов вторичной структуры указана в табл. 1. В качестве примера белков, в которых вторичные амфифильные структуры, по-видимому, играют важную роль, можно привести порины. В них полярные и неполярные аминокислотные остатки в каждой из /3-цепей чередуются. Все полярные остатки находятся на одной стороне складчатого слоя, выстилая наполненную водой пору. Заметим, что все сказанное о порине носит гипотетический характер.
Таблица 1. Параметры вторичной структуры
| Структура | Периодичность или число остатков на виток | Расстояние между остатками, А | Радиус или ширина, А |
| | | | |
| | | | |
| | | | |
| Неизогнутая | 2,0 | 3,2–3,4 | 0,9–1,1 |
| (З-цепь | | | |
| Изогнутая /З-цепь | 2,3 | 3,3 | 1,0 |
| | | | |
| Зю-Спираль | 3,0 | 2,0 | 1,9 |
| а-Спираль | 3,6 | 1,5 | 2,3 |
а-спираль, в которой гидрофобные остатки встречаются через каждую вторую или третью мономерную единицу, должна иметь гидрофобную и полярную поверхности. Подобные структуры часто представляют в виде спирального кольца с указанием боковых цепей – так, как это сделано на рис. Вторичные амфифильные структуры могут возникать в ситуациях, схематически показанных на рис. ЗЛО.
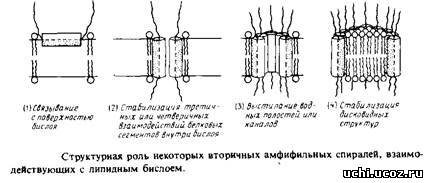
а. Поверхностно-активные сегменты белка; одна сторона спирали взаимодействует с гидрофобной областью липидного бислоя, а другая контактирует с водной фазой и полярной областью бислоя. Амфифильные а-спирали способны образовывать многие пептидные гормоны, а также разрушающие мембрану пептиды, например меллитин.
б. Трансмембранные элементы; неполярная поверхность спирали обращена к липидной фазе, а полярная выстилает водный канал, пронизывающий бислой. Это весьма распространенная модель, построенная главным образом исходя из результатов исследования никотинового ацетилхолинового рецептора, функционирующего как химически возбудимый канал. Однако основанные на экспериментальных данных выводы о том, что мембрану пронизывает именно амфифильная спираль, вызвали возражения. Такой наполненный водой канал, как в порине, может образовать и амфифильная 3-цепь.
в. Трансмембранные элементы; неполярная часть поверхности контактирует с липидами, а полярные группы – с полярными группами других трансмембранных элементов. Именно этот принцип лежит в основе «вывернутых» структур, каким предположительно является бактериородопсин. Полярные взаимодействия между амфифильными спиралями в принципе могли бы стабилизировать взаимодействия между субъединицами в олигомерных белках.
3. Третичные амфифильные структуры. Об их существовании можно говорить только предположительно. Их гидрофобная поверхность должна формироваться на уровне третичной структуры остатков, расположенных в самых разных участках полипептидной цепи. Подобные структуры могут быть характерны для белков, связывающихся с бислоем, но не имеющих четко выраженных гидрофобных доменов, определяемых по любому из указанных выше критериев. Возможным примером такого рода является а-лактальбумин.
Ионизируемые аминокислотные остатки в трансмембранных сегментах
Многие модели мембранных белков предполагают, что в их трансмембранных сегментах находятся ионизируемые остатки. Эти остатки, вероятно, играют важную функциональную и / или структурную роль. В некоторых случаях эта роль однозначно установлена: 1) остатки лизина в бактериородопсине и родопсине образуют шиффовы основания с простетической группой ретиналя, что необходимо для светового возбуждения молекулы; 2) остатки гистидина в полипептидах реакционного центра бактерий участвуют в связывании с фотосинтетическими пигментами; 3) заряженные остатки в лактозопермеазе из Е. coli участвуют в осуществлении этим белком транспортных функций; возможно, эти остатки образуют сеть водородных связей внутри молекулы белка.
Перенос заряженных групп из воды в среду с низкой диэлектрической проницаемостью внутри мембраны энергетически очень невыгоден, и эти группы необходимо каким-либо образом стабилизировать. Неоднократно предполагалось, что для стабилизации достаточно образования ионных пар, и этот принцип использовался при построении трехмерной модели бактериородопсина. Однако расчеты показали, что свободная энергия переноса ионной пары из воды в среду с низкой диэлектрической проницаемостью тоже весьма велика. Для дальнейшей стабилизации необходимы дополнительные полярные взаимодействия, возможно, с участием других полярных групп или с помощью водородных связей.
В принципе даже одиночная заряженная группа внутри мембраны может стабилизироваться через взаимодействия с полярными группами и при участии водородных связей, эффективно делокализующих заряд. Можно привести несколько примеров изолированных, де-сольватированных ионов, стабилизированных за счет взанмодействий в водорастворимых белках. Аналогичные принципы, по-видимому, действуют в случае заряженных остатков трансмембранных сегментов интегральных белков.
Однако представляется более вероятным, что ионизируемые аминокислоты нейтрализуются внутри мембраны за счет протонирования или депротонирования. Свободная энергия нейтрализации заряженных аминокислот, по оценкам, составляет примерно 10–17 ккал / моль. В отсутствие специфических условий для полярных взаимодействий, стабилизирующих заряженный остаток в трансмембранном сегменте, он скорее всего будет нейтрализован.
Заряженные аминокислоты в сегментах, экспонированных в водную среду
Как мы уже говорили, заряженные остатки распределены между двумя сторонами реакционного центра бактерий асимметрично. Такая асимметрия характерна и для некоторых других внутренних мембранных белков бактерий. Так, основные остатки Lys и Arg в четыре раза чаще встречаются в тех соединяющих трансмембранные элементы участках, которые расположены на внутренней стороне мембраны, а не на наружной. Для кислых остатков Asp и Glu подобная тенденция не выявляется. Возможно, эта асимметрия связана с механизмом сборки мембранного белка, но как именно – неясно. Более того, неизвестно, можно ли обобщить это наблюдение и имеет ли оно какую-либо предсказательную ценность.
В глобулярных, водорастворимых белках остатки пролина редко находятся в серединной части а-спирали. По данным исследований 58 белков, содержащих 331 а-спираль, выявлено 30 таких случаев. В половине из них пролин располагался в местах повреждения спирали, а в остальных случаях находился в области искривления или нерегулярности структуры.
В то же время у бактериородопсина пролиновые остатки расположены в средней части трех из семи трансмембранных спиралей, а у родопсина – в пяти из семи таких спиралей. Подобная тенденция выявлена и для других трансмембранных сегментов интегральных белков, особенно транспортных. Значение этого феномена неизвестно. Следует отметить, однако, что из-за наличия циклической боковой цепи пролин не образует водородных связей с остатками, находящимися на предыдущем витке а-спирали. Это может способствовать формированию структур, в которых водородная связь образуется за счет специфичного взаимодействия с остатком, расположенным в другом пронизывающем мембрану участке. Подобное полярное взаимодействие внутри бислоя могло бы стабилизировать трехмерную структуру мембранных белков.
Способы идентификации первичных амфифильных структур
Однозначная структурная информация о мембранных белках получена лишь в нескольких случаях, но зато в распоряжении исследователей имеются обширные данные об аминокислотной последовательности, основанные на результатах секвенирования ДНК. Для идентификации трансмембранных а-спиралей, предположительно имеющих длину – 20 остатков и состоящих преимущественно из гидрофобных аминокислот, разработано несколько методов анализа аминокислотной последовательности. В основе каждого из них лежит расположение аминокислот в ряд в соответствии с неким параметром, который отражает вероятность обнаружения этого остатка в трансмембранном сегменте.
Существует два типа шкал. В одном случае аминокислоты классифицируют по их относительной полярности или «гидрофобности». Эти шкалы имеют термодинамическую природу и основаны на величине изменения свободной энергии при переносе аминокислоты из водного раствора в углеводородную среду. Однако число способов количественной оценки гидрофобности аминокислот весьма велико, и они не во всем согласуются между соб